Cērijs ir neapstrīdams “lielais brālis” lielajā retzemju elementu saimē. Pirmkārt, kopējais retzemju elementu daudzums Zemes garozā ir 238 ppm, un cērijs ir 68 ppm, kas veido 28% no kopējā retzemju elementu sastāva un ieņem pirmo vietu; otrkārt, cērijs ir otrais retzemju elements, kas atklāts deviņus gadus pēc itrija atklāšanas (1794). Tā pielietojums ir ļoti plašs, un “cērijs” ir neapturams.
Cērija elementa atklāšana

Kārlis Auers fon Velsbahs
Cēriju 1803. gadā atklāja un nosauca vācietis Klopers, zviedru ķīmiķis Jones Jakobs Berzeliuss un zviedru mineralogs Vilhelms Hizingers. To sauc par ceriju, bet tā rūdu par cerītu, pieminot Cereru, asteroīdu, kas tika atklāts 1801. gadā. Faktiski šāda veida cērija silikāts ir hidratēts sāls, kas satur 66% līdz 70% cērija, bet pārējie ir kalcija, dzelzs unitrijs.
Pirmais cērija pielietojums bija gāzes kamīns, ko izgudroja Austrijas ķīmiķis Karls Auers fon Velsbahs. 1885. gadā viņš mēģināja izveidot magnija, lantāna un itrija oksīda maisījumu, taču šie maisījumi neveiksmīgi izstaroja zaļu gaismu.
1891. gadā viņš atklāja, ka tīrs torija oksīds rada labāku gaismu, lai gan tā ir zila, un sajaucot to ar cērija(IV) oksīdu, iegūst spilgti baltu gaismu. Turklāt cērija(IV) oksīdu var izmantot arī kā katalizatoru torija oksīda sadegšanai.
Cērija metāls

★ Cērijs ir elastīgs un mīksts, sudrabaini balts metāls ar aktīvām īpašībām. Saskaroties ar gaisu, tas oksidējas, veidojot rūsai līdzīgu lobāmu oksīda slāni. Karsējot tas deg un ātri reaģē ar ūdeni. Centimetra lielumā esošs cērija metāla paraugs pilnībā korodē aptuveni gada laikā. Izvairieties no saskares ar gaisu, spēcīgiem oksidētājiem, stiprām skābēm un halogēniem.
★ Cērijs galvenokārt ir atrodams monazītā un bastnezītā, kā arī urāna, torija un plutonija dalīšanās produktos. Kaitīgs videi, īpaša uzmanība jāpievērš ūdenstilpju piesārņojumam.
★ Cērijs ir 26. visizplatītākais elements, kas Zemes garozā veido 68 ppm, otrajā vietā aiz vara (68 ppm). Cērijs ir sastopams biežāk nekā parastie metāli, piemēram, svins (13 ppm) un alva (2,1 ppm).
Cērija elektronu konfigurācija
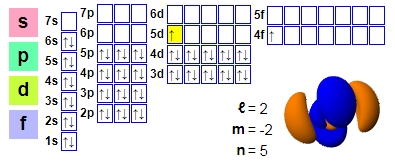
Elektroniskie pasākumi:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p66s2 4f1 5d1
★ Cērijs atrodas aiz lantāna un tam ir 4f elektroni, kas sākas no cērija, tāpēc tam ir viegli piedalīties ķīmiskajās reakcijās. Tomēr cērija 5d orbitāle ir aizņemta, un šis efekts cērijā nav pietiekami spēcīgs.
★ Lielākā daļa lantanīdu var izmantot tikai trīs elektronus kā valences elektronus, izņemot ceriju, kam ir mainīga elektroniskā struktūra. 4f elektronu enerģija ir gandrīz tāda pati kā ārējiem 5d un 6s elektroniem, kas delokalizēti metāla stāvoklī, un ir nepieciešams tikai neliels enerģijas daudzums, lai mainītu šo elektroniskās enerģijas līmeņu relatīvo aizņemtību, kā rezultātā rodas dubultā valence +3 un +4. Normālais stāvoklis ir +3 valence, kas anaerobā ūdenī uzrāda +4 valenci.
Cērija pielietojums

★ Var izmantot kā sakausējuma piedevu un cērija sāļu ražošanai utt.
★ To var izmantot kā stikla piedevu ultravioleto un infrasarkano staru absorbēšanai, un to plaši izmanto automašīnu stiklos.
★ Var izmantot kā lielisku vides aizsardzības materiālu, un pašlaik visreprezentatīvākais ir automobiļu izplūdes gāzu attīrīšanas katalizators, kas efektīvi novērš liela daudzuma automobiļu izplūdes gāzu noplūdi gaisā.
★ Gaismaretzemju elementigalvenokārt sastāv no cērija, jo augu augšanas regulatori var uzlabot kultūraugu kvalitāti, palielināt ražu un uzlabot kultūraugu izturību pret stresu.
★ Cērija sulfīds var aizstāt pigmentos tādus metālus kā svins un kadmijs, kas ir kaitīgi videi un cilvēkiem, var krāsot plastmasu un to var izmantot arī pārklājumu un tintes rūpniecībā.
★Cērija(IV) oksīdsvar izmantot kā pulēšanas pastu, piemēram, ķīmiski mehāniskajā pulēšanā (ĶMP).
★ Cēriju var izmantot arī kā ūdeņraža uzglabāšanas materiālus, termoelektriskus materiālus, cērija volframa elektrodus, keramikas kondensatorus, pjezoelektrisko keramiku, cērija silīcija karbīda abrazīvus, degvielas elementu izejvielas, benzīna katalizatorus, pastāvīgos magnētiskos materiālus, medicīniskos materiālus, dažādus leģētos tēraudus un krāsainos metālus.
Publicēšanas laiks: 2023. gada 3. jūlijs