Skandijs, ar elementa simbolu Sc un atomnumuru 21, viegli šķīst ūdenī, var mijiedarboties ar karstu ūdeni un viegli kļūst tumšāks gaisā. Tā galvenā valence ir +3. To bieži sajauc ar gadolīniju, erbiju un citiem elementiem, iegūstot zemu ražu un aptuveni 0,0005% saturu garozā. Skandiju bieži izmanto īpaša stikla un vieglu augstas temperatūras sakausējumu ražošanai.
Pašlaik pasaulē pierādītās skandija rezerves ir tikai 2 miljoni tonnu, no kurām 90–95% ir boksīta, fosforīta un dzelzs-titāna rūdās, bet neliela daļa – urāna, torija, volframa un retzemju rūdās, kas galvenokārt atrodas Krievijā, Ķīnā, Tadžikistānā, Madagaskarā, Norvēģijā un citās valstīs. Ķīna ir ļoti bagāta ar skandija resursiem, ar milzīgām skandija minerālu rezervēm. Saskaņā ar nepilnīgu statistiku, skandija rezerves Ķīnā ir aptuveni 600 000 tonnu, kas atrodas boksīta un fosforīta atradnēs, porfīra un kvarca vēnu volframa atradnēs Dienvidķīnā, retzemju atradnēs Dienvidķīnā, Bajan Obo retzemju dzelzsrūdas atradnē Iekšējā Mongolijā un Pandžihua vanādija-titāna magnetīta atradnē Sičuaņā.
Skandija trūkuma dēļ arī skandija cena ir ļoti augsta, un savā kulminācijā skandija cena bija 10 reizes augstāka nekā zelta cena. Lai gan skandija cena ir kritusies, tā joprojām ir četras reizes augstāka nekā zelta cena!
Vēstures atklāšana
1869. gadā Mendeļejevs pamanīja atommasas atšķirību starp kalciju (40) un titānu (48) un prognozēja, ka šeit pastāv arī neatklāts starpposma atommasas elements. Viņš prognozēja, ka tā oksīds ir X₂OÅ. Skandiju 1879. gadā atklāja Larss Frederiks Nilsons no Upsalas Universitātes Zviedrijā. Viņš to ieguva no melnā retā zelta raktuves, sarežģītas rūdas, kas satur 8 metālu oksīdu veidus. Viņš ir ieguvisErbija(III) oksīdsno melnās retās zelta rūdas un iegūtsIterbija(III) oksīdsno šī oksīda, un ir vēl viens vieglāka elementa oksīds, kura spektrs rāda, ka tas ir nezināms metāls. Šis ir Mendeļejeva prognozētais metāls, kura oksīds irSc₂O₃Pats skandija metāls tika ražots noSkandija hlorīdsar elektrolītiskās kausēšanas metodi 1937. gadā.
Mendeļejevs
Elektronu konfigurācija
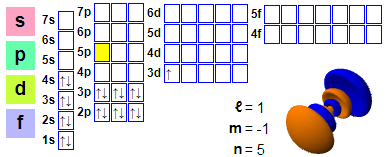
Elektronu konfigurācija: 1s2 2s2 2p6 3s2 3p6 4s2 3d1
Skandijs ir mīksts, sudrabaini balts pārejas metāls ar kušanas temperatūru 1541 ℃ un viršanas temperatūru 2831 ℃.
Ilgu laiku pēc skandija atklāšanas tā izmantošana netika demonstrēta tā ražošanas grūtību dēļ. Līdz ar retzemju elementu atdalīšanas metožu pieaugošo uzlabošanos tagad ir nobriedusi skandija savienojumu attīrīšanas procesa plūsma. Tā kā skandijs ir mazāk sārmains nekā itrijs un lantanīds, hidroksīds ir visvājākais, tāpēc retzemju elementu jauktais minerāls, kas satur skandiju, tiks atdalīts no retzemju elementa ar "pakāpeniskas nogulsnēšanas" metodi, kad skandija(III) hidroksīds pēc pārnešanas šķīdumā tiek apstrādāts ar amonjaku. Otra metode ir skandija nitrāta atdalīšana, izmantojot nitrāta polāro sadalīšanos. Tā kā skandija nitrāts ir visvieglāk sadalāms, skandiju var atdalīt. Turklāt svarīgs skandija avots ir arī visaptveroša pavadošā skandija atgūšana no urāna, torija, volframa, alvas un citiem minerālu atradnēm.
Pēc tīra skandija savienojuma iegūšanas to pārvērš par ScCl Å un izkausē kopā ar KCl un LiCl. Izkausēto cinku izmanto kā katodu elektrolīzē, izraisot skandija nogulsnēšanos uz cinka elektroda. Pēc tam cinku iztvaicē, iegūstot metālisku skandiju. Tas ir viegls sudrabaini balts metāls ar ļoti aktīvām ķīmiskām īpašībām, kas var reaģēt ar karstu ūdeni, veidojot ūdeņraža gāzi. Tātad attēlā redzamais metāliskais skandijs ir ievietots pudelē un aizsargāts ar argona gāzi, pretējā gadījumā skandijs ātri veidos tumši dzeltenu vai pelēku oksīda slāni, zaudējot savu spīdīgo metālisko spīdumu.
Pieteikumi
Apgaismojuma nozare
Skandija pielietojums ir koncentrēts ļoti spilgtos virzienos, un nav pārspīlēti to saukt par Gaismas Dēlu. Pirmais skandija maģiskais ierocis ir skandija-nātrija lampa, ko var izmantot, lai apgaismotu tūkstošiem mājsaimniecību. Tā ir metālhalogenīdu elektriskā spuldze: spuldze ir piepildīta ar nātrija jodīdu un skandija trijodīdu, un vienlaikus tiek pievienots skandijs un nātrija folija. Augstsprieguma izlādes laikā skandija joni un nātrija joni attiecīgi izstaro gaismu ar raksturīgiem emisijas viļņu garumiem. Nātrija spektra līnijas ir 589,0 un 589,6 nm, kas ir divas slavenas dzeltenas gaismas, savukārt skandija spektra līnijas ir 361,3–424,7 nm, kas ir virkne tuvu ultravioletās un zilās gaismas emisiju. Tā kā tās viena otru papildina, kopējā radītā gaismas krāsa ir balta gaisma. Tieši tāpēc, ka skandija-nātrija lampām piemīt augsta gaismas efektivitāte, laba gaismas krāsa, enerģijas taupīšana, ilgs kalpošanas laiks un spēcīga miglas izkliedēšanas spēja, tās var plaši izmantot televīzijas kamerās, laukumos, sporta norises vietās un ceļu apgaismojumā, un tās ir pazīstamas kā trešās paaudzes gaismas avoti. Ķīnā šāda veida lampas pakāpeniski tiek popularizētas kā jauna tehnoloģija, savukārt dažās attīstītajās valstīs šāda veida lampas tika plaši izmantotas jau 20. gs. astoņdesmito gadu sākumā.
Otrais skandija maģiskais ierocis ir saules fotoelektriskās šūnas, kas var savākt uz zemes izkliedēto gaismu un pārvērst to elektrībā, lai veicinātu cilvēku sabiedrības attīstību. Skandijs ir labākais barjermetāls metāla izolatoros, pusvadītāju silīcija saules baterijās un saules baterijās.
Tā trešo maģisko ieroci sauc par γA staru avotu; šis maģiskais ierocis var spoži spīdēt pats par sevi, taču šāda veida gaismu nevar uztvert ar neapbruņotu aci, tā ir augstas enerģijas fotonu plūsma. Mēs parasti iegūstam 45Sc no minerāliem, kas ir vienīgie dabiskie skandija izotopi. Katrs 45Sc kodols satur 21 protonu un 24 neitronus. 46Sc, mākslīgs radioaktīvs izotops, var tikt izmantots kā γ starojuma avoti vai marķieru atomus, ko var izmantot arī ļaundabīgu audzēju staru terapijā. Ir arī tādi pielietojumi kā itrija-gallija skandija granāta lāzers,Skandija fluorīdsstikla infrasarkanā optiskā šķiedra un ar skandiju pārklāta katodstaru lampa televīzijā. Šķiet, ka skandijs rodas ar spilgtumu.
Sakausējumu rūpniecība
Skandijs elementārā formā ir plaši izmantots alumīnija sakausējumu dopēšanai. Pievienojot alumīnijam dažas tūkstošdaļas skandija, veidojas jauna Al3Sc fāze, kas alumīnija sakausējumā veic metamorfismu un būtiski maina sakausējuma struktūru un īpašības. Pievienojot 0,2%~0,4% Sc (kas ir ļoti līdzīgs sāls pievienošanas proporcijai mājas apstākļos ceptiem dārzeņiem, nepieciešams tikai neliels daudzums), var palielināt sakausējuma rekristalizācijas temperatūru par 150-200 ℃ un ievērojami uzlabot augstas temperatūras izturību, strukturālo stabilitāti, metināšanas veiktspēju un izturību pret koroziju. Tas var arī novērst trausluma parādību, kas viegli rodas ilgstoša darba laikā augstā temperatūrā. Augstas stiprības un augstas cietības alumīnija sakausējumi, jauni augstas stiprības korozijizturīgi metināmi alumīnija sakausējumi, jauni augstas temperatūras alumīnija sakausējumi, augstas stiprības neitronu apstarošanas izturīgi alumīnija sakausējumi utt. piedāvā ļoti pievilcīgas attīstības perspektīvas kosmosa, aviācijas, kuģu, kodolreaktoru, vieglo transportlīdzekļu un ātrgaitas vilcienu nozarēs.
Skandijs ir arī lielisks dzelzs modifikators, un neliels skandija daudzums var ievērojami uzlabot čuguna izturību un cietību. Turklāt skandiju var izmantot arī kā piedevu augstas temperatūras volframa un hroma sakausējumiem. Protams, papildus kāzu apģērbu izgatavošanai citiem, skandijam ir augsta kušanas temperatūra, un tā blīvums ir līdzīgs alumīnijam, un to izmanto arī augstas kušanas temperatūras vieglajos sakausējumos, piemēram, skandija titāna sakausējumā un skandija magnija sakausējumā. Tomēr augstās cenas dēļ to parasti izmanto tikai augstas klases ražošanas nozarēs, piemēram, kosmosa kuģos un raķetēs.
Keramikas materiāls
Skandijs, viena viela, parasti tiek izmantots sakausējumos, un tā oksīdi līdzīgā veidā spēlē svarīgu lomu keramikas materiālos. Tetragonālajam cirkonija keramikas materiālam, ko var izmantot kā elektroda materiālu cieto oksīdu degvielas elementiem, ir unikāla īpašība, ka šī elektrolīta vadītspēja palielinās, palielinoties temperatūrai un skābekļa koncentrācijai vidē. Tomēr šī keramikas materiāla kristāliskā struktūra pati par sevi nevar pastāvēt stabili un tai nav rūpnieciskas vērtības; ir nepieciešams pievienot dažas vielas, kas var fiksēt šo struktūru, lai saglabātu tās sākotnējās īpašības. Pievienojot 6–10% skandija oksīda, tas ir līdzīgs betona struktūrai, lai cirkoniju varētu stabilizēt uz kvadrātveida režģa.
Ir arī inženiertehniskie keramikas materiāli, piemēram, augstas stiprības un augstas temperatūras izturīgs silīcija nitrīds kā blīvētāji un stabilizatori.
Kā blīvētājs,Skandija oksīdsVar veidot ugunsizturīgu fāzi Sc2Si2O7 smalko daļiņu malā, tādējādi samazinot inženierkeramikas deformāciju augstā temperatūrā. Salīdzinot ar citiem oksīdiem, tas var labāk uzlabot silīcija nitrīda mehāniskās īpašības augstā temperatūrā.
Katalītiskā ķīmija
Ķīmiskajā inženierijā skandiju bieži izmanto kā katalizatoru, savukārt Sc2O3 var izmantot etanola vai izopropanola dehidratācijai un deoksidēšanai, etiķskābes sadalīšanai un etilēna ražošanai no CO un H2. PtAl katalizators, kas satur Sc2O3, ir arī svarīgs katalizators smago eļļu hidrogenēšanas attīrīšanas un rafinēšanas procesos naftas ķīmijas rūpniecībā. Katalītiskās krekinga reakcijās, piemēram, kumēnā, Sc-Y ceolīta katalizatora aktivitāte ir 1000 reižu augstāka nekā alumīnija silikāta katalizatora aktivitāte; salīdzinot ar dažiem tradicionālajiem katalizatoriem, skandija katalizatoru attīstības perspektīvas būs ļoti spilgtas.
Kodolenerģijas nozare
Pievienojot nelielu daudzumu Sc2O3 UO2 augstas temperatūras reaktora kodoldegvielai, var novērst režģa transformāciju, tilpuma palielināšanos un plaisāšanu, ko izraisa UO2 pārvēršana U3O8.
Degvielas elements
Līdzīgi, pievienojot niķeļa sārma akumulatoriem 2,5–25 % skandija, tiks palielināts to kalpošanas laiks.
Lauksaimniecības selekcija
Lauksaimniecībā tādas sēklas kā kukurūza, bietes, zirņi, kvieši un saulespuķes var apstrādāt ar skandija sulfātu (koncentrācija parasti ir 10⁻³~10⁻¹⁸ mol/l, dažādiem augiem tā būs atšķirīga), un ir panākta faktiskā dīgtspēju veicinošā ietekme. Pēc 8 stundām sakņu un pumpuru sausnas svars palielinājās attiecīgi par 37% un 78% salīdzinājumā ar stādiem, taču mehānisms joprojām tiek pētīts.
No Nīlsena uzmanības atommasas datu parādam līdz mūsdienām skandijs cilvēku redzeslokā ir nonācis tikai simt vai divdesmit gadus, bet simts gadus tas gandrīz ir nosēdējis uz soliņa. Tikai materiālzinātnes enerģiskā attīstība pagājušā gadsimta beigās viņam ienesa vitalitāti. Mūsdienās retzemju elementi, tostarp skandijs, ir kļuvuši par karstām zvaigznēm materiālzinātnē, spēlējot pastāvīgi mainīgas lomas tūkstošiem sistēmu, katru dienu ienesot mūsu dzīvē vairāk ērtību un radot ekonomisko vērtību, ko ir vēl grūtāk izmērīt.
Publicēšanas laiks: 2023. gada 29. jūnijs