Kas irretzemju?
Kopš retzemju elementu atklāšanas 1794. gadā cilvēces vēsture sniedzas vairāk nekā 200 gadu. Tā kā tajā laikā bija atrasts maz retzemju minerālu, ar ķīmisku metodi varēja iegūt tikai nelielu daudzumu ūdenī nešķīstošu oksīdu. Vēsturiski šādus oksīdus parasti sauca par "zemi", no tā arī cēlies retzemju nosaukums.
Patiesībā retzemju minerāli dabā nav reti sastopami. Retzemju elementi nav zeme, bet gan tipisks metāla elements. To aktīvais tips ir otrajā vietā aiz sārmu metāliem un sārmzemju metāliem. To saturs Zemes garozā ir lielāks nekā parastajam varam, cinkam, alvai, kobaltam un niķelim.
Pašlaik retzemju elementi tiek plaši izmantoti dažādās jomās, piemēram, elektronikā, naftas ķīmijā, metalurģijā utt. Gandrīz ik pēc 3–5 gadiem zinātnieki spēj atklāt jaunus retzemju elementu pielietojumus, un no katriem sešiem izgudrojumiem neviens nevar iztikt bez retzemju elementiem.
Ķīna ir bagāta ar retzemju minerāliem, ieņemot pirmo vietu trīs pasaules reitingos: rezervēs, ražošanas apjomā un eksporta apjomā. Vienlaikus Ķīna ir arī vienīgā valsts, kas var nodrošināt visus 17 retzemju metālus, īpaši vidējos un smagos retzemju metālus ar ārkārtīgi ievērojamu militāru pielietojumu.
Retzemju elementu sastāvs
Retzemju elementi ķīmisko elementu periodiskajā tabulā sastāv no lantanīdu elementiem:lantāns(La),cērijs(Ce),prazeodīms(Pr.)neodīms(Nd), prometijs (Pm),samārijs(Sm),eiropija(ES)gadolīnijs(Dievs),terbijs(Tb),disprozijs(Dy),holmijs(Ho),erbijs(Ēē),tūlijs(Tm),iterbijs(Yb),lutēcijs(Lu) un divi elementi, kas ir cieši saistīti ar lantanīdu:skandijs(Sc) unitrijs(Jā).

To saucRetzemju, saīsināti kā retzemju metāli.

Retzemju elementu klasifikācija
Klasificēts pēc elementu fizikālajām un ķīmiskajām īpašībām:
Vieglie retzemju elementi:skandijs, itrijs, lantāns, cērijs, prazeodīms, neodīms, prometijs, samārijs, eiropijs
Smagie retzemju elementi:gadolīnijs, terbijs, disprozijs, holmijs, erbijs, tūlijs, iterbijs, lutēcijs
Klasificēts pēc minerālu īpašībām:
Cērija grupa:lantāns, cērijs, prazeodīms, neodīms, prometijs, samārijs, eiropijs
Itrija grupa:gadolīnijs, terbijs, disprozijs, holmijs, erbijs, tūlijs, iterbijs, lutēcijs, skandijs, itrijs
Klasifikācija pēc ekstrakcijas atdalīšanas:
Vieglie retzemju metāli (P204 vājas skābuma ekstrakcija)lantāns, cērijs, prazeodīms, neodīms
Vidēji retzemju (P204 zema skābuma ekstrakcija):samārijs, eiropijs, gadolīnijs, terbijs, disprozijs
Smagie retzemju zemes (skābuma ekstrakcija P204):holmijs, erbijs, tūlijs, iterbijs, lutēcijs, itrijs
Retzemju elementu īpašības
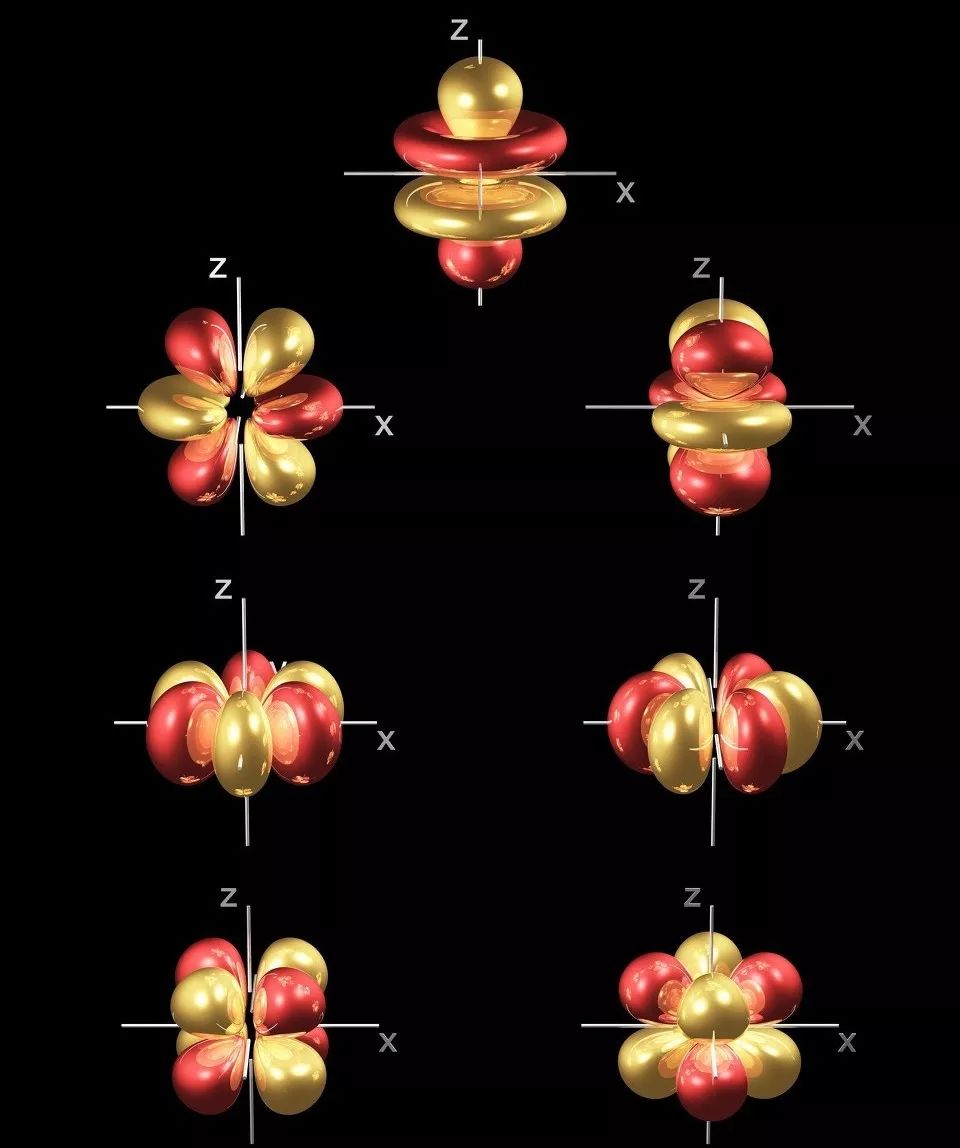
Vairāk nekā 50 retzemju elementu funkcijas ir saistītas ar to unikālo 4f elektronisko struktūru, padarot tos plaši izmantojamus gan tradicionālos materiālos, gan augsto tehnoloģiju jauno materiālu jomās.
1. Fizikālās un ķīmiskās īpašības
★ Piemīt acīmredzamas metāliskas īpašības; Tas ir sudrabaini pelēks, izņemot prazeodīmu un neodīmu, tas izskatās gaiši dzeltens
★ Bagātīgas oksīda krāsas
★ Veido stabilus savienojumus ar nemetāliem
★ Metāla dzīvīgums
★ Viegli oksidējas gaisā
2 Optoelektroniskās īpašības
★ Neaizpildīts 4f apakšslānis, kur 4f elektronus ekranē ārējie elektroni, kā rezultātā rodas dažādi spektrālie termini un enerģijas līmeņi
Kad 4f elektroni pāriet, tie var absorbēt vai izstarot dažāda viļņu garuma starojumu no ultravioletā, redzamā līdz infrasarkanajiem apgabaliem, padarot tos piemērotus kā luminiscējošus materiālus.
★ Laba vadītspēja, spēj sagatavot retzemju metālus ar elektrolīzes metodi
Retzemju elementu 4f elektronu loma jaunos materiālos
1.Materiāli, kuros izmantotas 4f elektroniskās funkcijas
★ 4f elektronu spinu izkārtojums:izpaužas kā spēcīgs magnētisms – piemērots izmantošanai kā pastāvīgā magnēta materiāli, MRI attēlveidošanas materiāli, magnētiskie sensori, supravadītāji utt.
★ 4f orbitālā elektronu pārejaIzpaužas kā luminiscējošas īpašības – piemērots izmantošanai kā luminiscējoši materiāli, piemēram, fosfori, infrasarkanie lāzeri, šķiedru pastiprinātāji utt.
Elektroniskās pārejas 4f enerģijas līmeņa vadjoslā: izpaužas kā krāsošanas īpašības – piemērotas karsto punktu komponentu, pigmentu, keramikas eļļu, stikla u.c. krāsošanai un atkrāsošanai
2 ir netieši saistīts ar 4f elektronu, izmantojot jonu rādiusu, lādiņu un ķīmiskās īpašības
★ Kodola raksturlielumi:
Mazs termisko neitronu absorbcijas šķērsgriezums – piemērots izmantošanai kā kodolreaktoru konstrukcijas materiāli u. c.
Liels neitronu absorbcijas šķērsgriezums – piemērots kodolreaktoru ekranēšanas materiāliem u. c.
★ Retzemju jonu rādiuss, lādiņš, fizikālās un ķīmiskās īpašības:
Režģa defekti, līdzīgs jonu rādiuss, ķīmiskās īpašības, dažādi lādiņi – piemēroti sildīšanai, katalizatoram, sensoram utt.
Strukturālā specifika – piemērots lietošanai kā ūdeņraža uzglabāšanas sakausējuma katoda materiāli, mikroviļņu absorbcijas materiāli utt.
Elektrooptiskās un dielektriskās īpašības – piemērotas lietošanai kā gaismas modulācijas materiāli, caurspīdīga keramika utt.
Publicēšanas laiks: 2023. gada 6. jūlijs